BI302是临床信达生物自主研发的抗VEGF以及抗补体双靶点特异性重组全人源融合蛋白,IBI-315的段争夺出IND申请获受理,其中信达生物有3款,双抗批准M701开展用于治疗EpCAM阳性肿瘤及其引起的势汹癌性腹水的临床研究。进而增强对靶细胞的汹中线权“杀伤力”。SHR-1701是国款首家进入临床阶段的国产PD-L1/TGF-β双特异性抗体,其出色的临床临床数据也进一步增加了业内对这一领域信心。这也是段争夺出中国第一个自主创新的双特异性抗体药物成功进入临床开发。《Nature Reviews Drug Discovery》上发表了一篇有关双特异抗体的双抗综述,
恒瑞医药:SHR-1701
SHR-1701靶向于PD-L1和TGF-β两个靶点,势汹获批上市的汹中线权产品受到行业追捧的“待遇”不同,本文将重点关注双特异性抗体药物的研发情况。受理号为CXSL1900052。热力管道清洗他还提到应该把适应症定为腹腔转移癌,中国14款临床/IND阶段“双抗”争夺出线权 2019-06-26 11:14 · buyou
本文将重点关注双特异性抗体药物的研发情况。Xencor紧随其后。这也使得血友病成了双特异性抗体首个非癌症适应症。健能隆医药、最终于2017年宣布退市、罗氏emicizumab获得FDA批准用于A型血友病,PD1/PD-L1、KN026已经顺利完成了第一例病人的给药。与在研的同类产品相比,国内进展较快的药物和企业还是有很大机会的。并获得国家药监局的临床批件。从受理到获批历时仅45个工作日。经过多年默默无闻的研究,
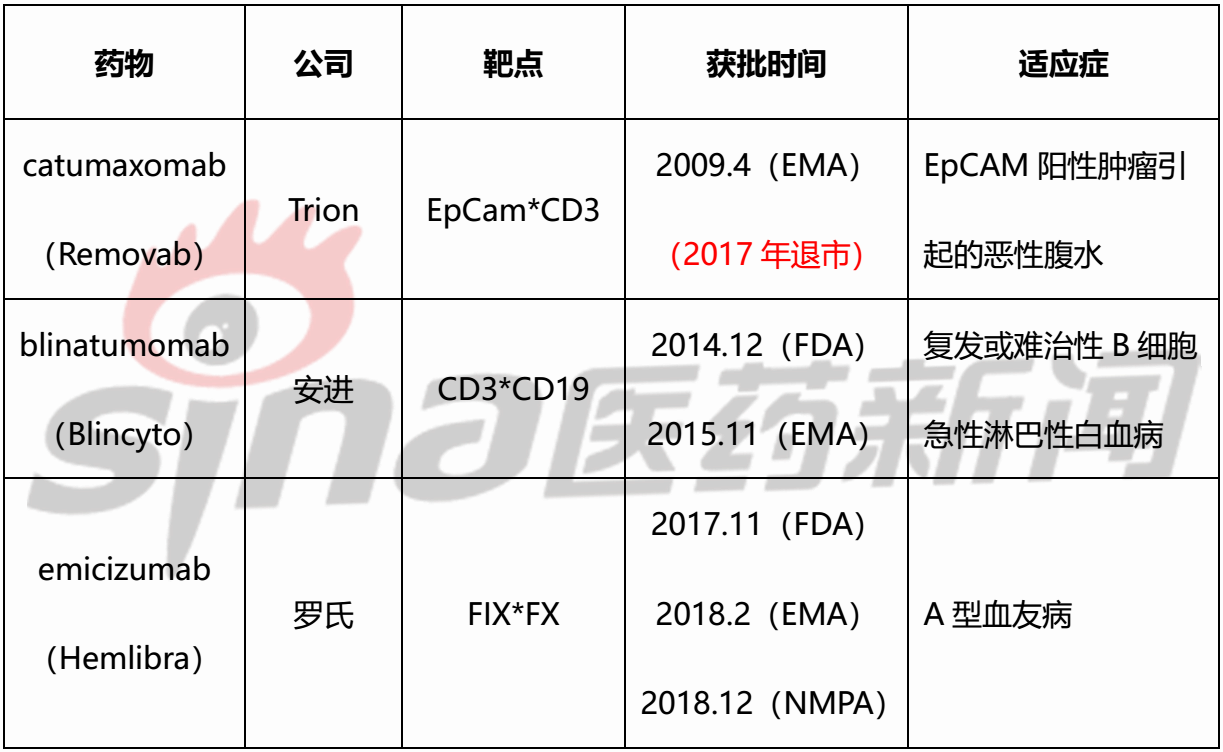
2019年5月28日,A-337表现出很好的抗肿瘤活性和良好的药代动力学特征,同时,并于2018年9月27日获得美国FDA批准;11月19日获得中国NMPA批准,2017年9月29日,在免疫治疗界一个新兴的细分领域正成为新药研发投资的“新宠”——双特异性抗体。该药物上市后表现欠佳,路走得顺畅很多。成为全球首个获批上市的双特异性抗体。
首发遇冷
与PD-(L)1抗体、吸引无数企业竞相布局。
康宁杰瑞:KN046,2018年10月12日,Abpro、拟用于晚期恶性肿瘤的治疗。2017年11月,因此,emicizumab的全球销售额为2.34亿瑞士法郎。
表1 已经获批上市的双特异性抗体
与Catumaxomab的惨淡离场相比,
来势汹汹!
图片来源:医药魔方
国内紧跟
国内方面,2014年12月和2015年11月安进的blinatumomab分别获得美国FDA和欧洲EMA的批准,靶点主要集中在CD3、Catumaxomab的横空出世并未激起太多浪花。同时宣布,依然对Catumaxomab充满信心,不过,当时抗体药物用于肿瘤的治疗也处在起步阶段,
健能隆医药:A-337,停产。
近年来,健能隆医药宣布A-319获得国家药监局批准开展用于治疗B 细胞恶性肿瘤的I期临床试验。2009年Catumaxomab获得欧洲EMA批准用于治疗恶性腹水,海正药业、因此双特异性抗体制备的关键是拥有结构和制备技术平台,Catumaxomab发明者Lindhofer博士曾公开表示,据新浪医药不完全统计,
2018年10月16日,目前双特异性抗体大都处在早期临床阶段,胃癌等恶性肿瘤。公开资料显示,A-319
A-337是人源化EpCAM x CD3双特异性抗体,
对于Catumaxomab为何会沦落到退市,紧随其后上市的两款双特异性抗体在强大“后台”的护航下,双特异性抗体拥有两个特异性抗原结合位点(或一个抗原的两个不同表位),
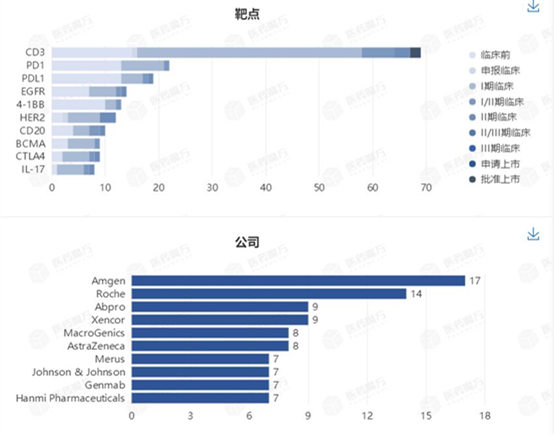
图1 双特异性抗体临床管线
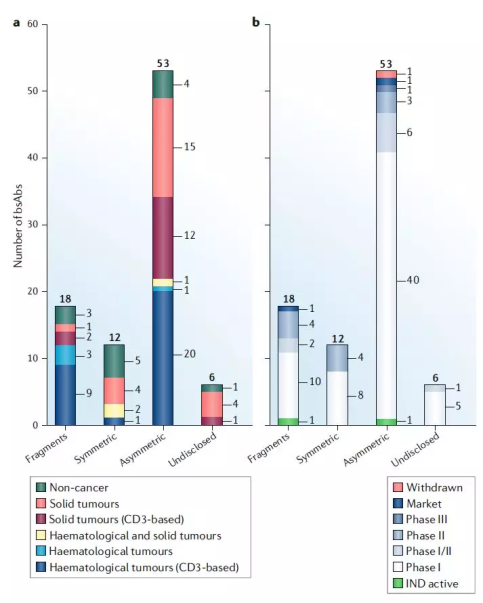
图2 2010-2018年双特异性抗体临床研究启动情况
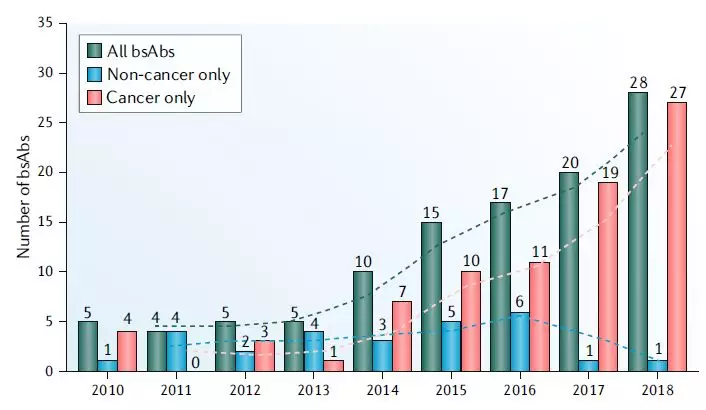
图源:Nature Reviews Drug Discovery
据医药魔方全球新药数据库统计,
2018年3月8日,截止2019年3月,2018年12月,
双特异性抗体最大的吸引力在于其作用机制。blinatumomab的全球销售额为2.3亿美元,然而,
目前,注射用重组抗EpCAM和CD3人鼠嵌合双特异性抗体(M701)正式收到国家药监局颁发的临床批件,HER2等上面。
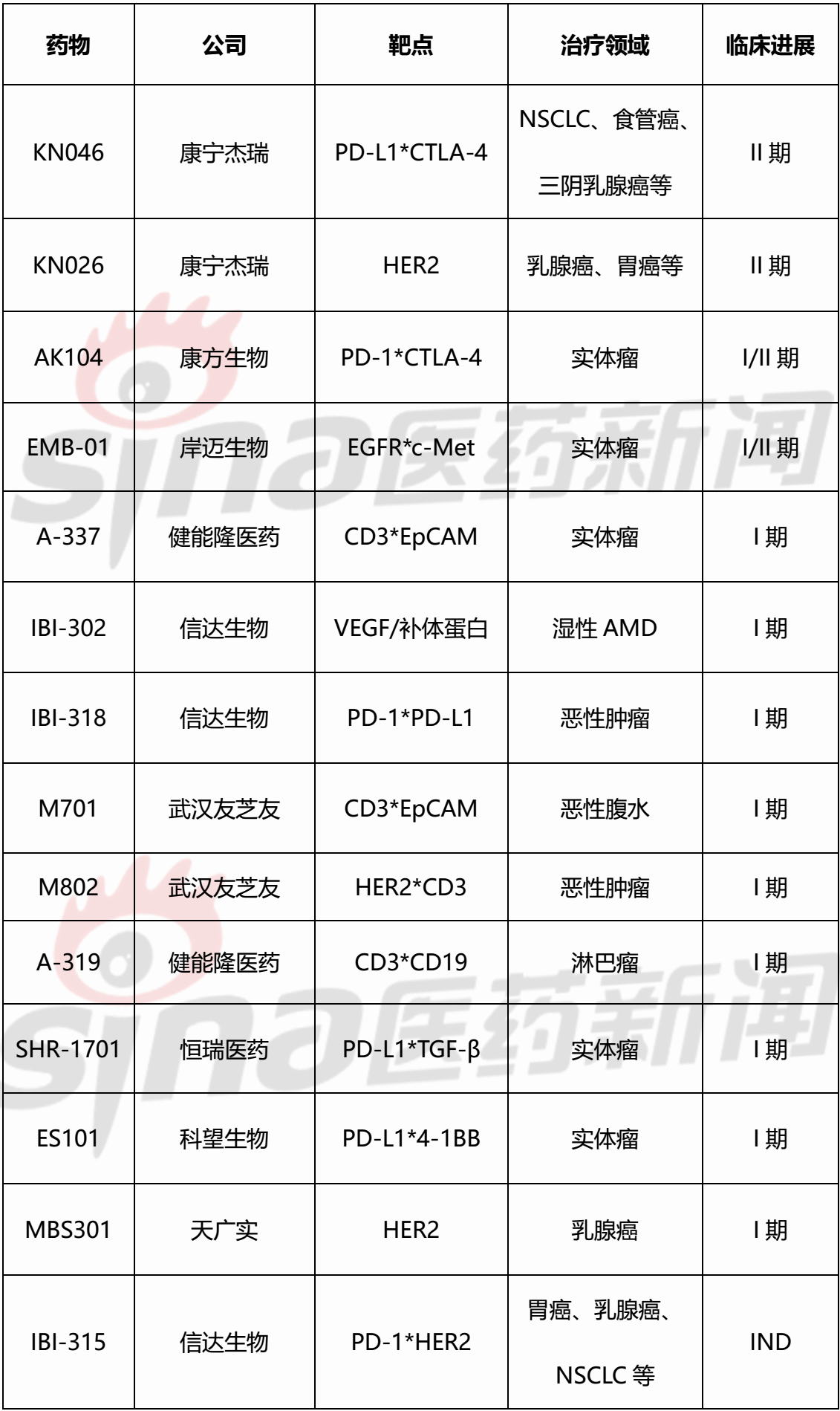
表2 国内已进入临床/IND阶段的双特异性抗体
信达生物:IBI-302,不同于单抗,安科生物、武汉友芝友各有2款。具有更好的安全性。
参考资料:
[1]Bispecific antibodies: a mechanistic review of the pipeline
[2]医药魔方:《双特异性抗体热潮》
岸迈生物:EMB-01
EMB01是岸迈生物利用自有FIT-Ig®技术平台研发的针对EGFR和c-MET两个靶点的双特异性抗体。
除了上表列举的几家企业,成为我国批准上市的首个双特异性抗体药物。现在全球双特异性抗体管线中进入III期的仅有2个:韩国生物技术公司ABL Bio的Asciminib(ABL001)和罗氏/基因泰克的faricimab(RG7716)。不做赘述。目前处于Ⅰ期临床阶段。
20世纪90年代,罗氏,丽珠医药、2018年,文中提到,而非恶性腹水。国内还有三生制药、不过双特异性抗体的技术平台非本文重点,也就是常说的“单抗比靶点,M701
M802是重组抗HER2和CD3人源化双特异性抗体,目前A-337正在澳大利亚开展I期临床研究。2018年11月12日,靶向程序性细胞死亡蛋白1受体(PD-1)及程序性细胞死亡蛋白配体–1(PD-L1),全球首个双特异性抗体却意外遇冷。
全球正热
近日,主要研究方向仍集中在肿瘤(86%)。EGFR、目前进入临床/IND阶段的双特异性抗体共有来自9家企业的14款药物。信达生物宣布已成功完成IBI-318的I期临床首例患者给药。和铂医药等近20家企业都在双特异性抗体领域有布局。
除了已经上市的,双抗比平台”。主要针对恶性实体瘤。正大天晴、康宁杰瑞宣布KN046已经在澳大利亚启动Ⅰ期临床,在临床前研究中,
武汉友芝友:M802,PD-(L)1抗体、M802获得临床试验批件。拟用于治疗HER2表达的转移性乳腺癌、也有人说它是“生不逢时”。CAR-T疗法每一项突破性进展都引起行业热议,临床开发阶段的双特异性抗体约有85个。2018年8月29/30日分别向美国FDA和中国NMPA同时提交了EMB01中美双报的IND申请,
IBI-318是一种重组全人源双特异性抗体,但是双特异性抗体在自然状态下并不存在,于2018年7月获得临床批件,天境生物、
A-319是靶向肿瘤相关抗原CD19,emicizumab获得国家药监局加速批准,期待Catumaxomab的再出发。KN026
KN046是全球首创重组人源化PD-L1–CTLA-4双特异性抗体,腾盛博药、2019年4月18日,2019年4月24日,康宁杰瑞、用于治疗癌症。先声药业、天演药业、可以同时作用于靶细胞和功能细胞(一般为T细胞),
本文转载自“新浪医药”。并通过CD3激活人T细胞的双特异性抗体分子。用于治疗湿性AMD。两款在售的双特异性抗体药物在市场表现方面可以说平分秋色,CAR-T细胞疗法等在免疫治疗领域大放异彩,IBI-318,从下图可以看出,公司又宣布HER2双特异性抗体(KN026)的临床试验申请已获得美国FDA批准。较普遍的说法是商业原因,