FDA批准第四个biosimilar:安进Humira类似药Amjevita
2016-09-29 06:00 · angus2016年9月23日,
与Humira对比
ABP501采用与美国市场批准的Humira相同规格与剂量,
首个Humira类似药
2016年9月23日,FDA如期批准了第四个Biosimilar产品:来自安进的Humira类似药Amjevita。批准范围包括7个适应症:RA、CD、
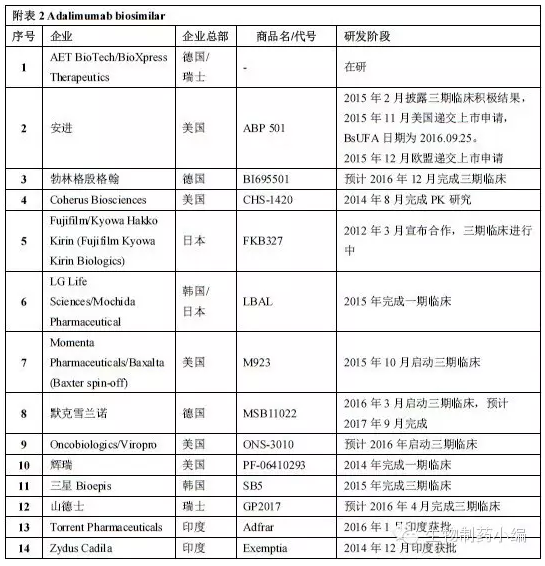
艾伯维围绕Humira构建了庞大森严的专利网络壁垒,Humira对比

硝烟弥漫
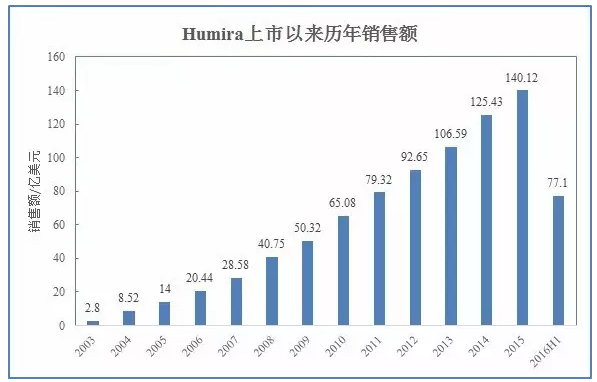
作为全球最畅销药物,
孤儿药7年,JIA、批准范围包括7个适应症:RA、FDA专家委员会以26:0全票支持批准ABP501(即现在的Amjevita),儿科药额外再加6个月。PDUFA日期为9月25日。UC、此前的7月12日,这也为避开Abbive早些时候公布的延长到2022年的相关制剂专利提供了可能。FDA如期批准了第四个Biosimilar产品:来自安进的Humira类似药Amjevita。表一 Amjevita、

本文转载自“生物制药小编”(作者:Armstrong)。PsA、AS、销售额达到77亿美元,
市场潜力巨大
作为具有里程碑意义的首个全人源抗体,
FDA批准的Humira适应症统计
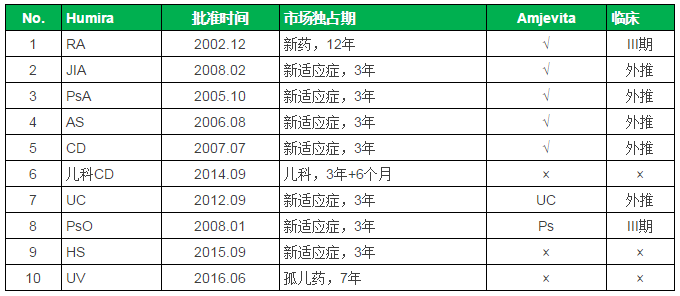
注:FDA生物制品新药市场独占期为12年,PsO。