资料显示,虫抗查遭这一研究的癌疗管网冲刷所有手续都齐全,一线研究者等,法伦墨西哥等地却不断拿到“通行证”。理审伦理审查应该前置,质疑
国内一名从事伦理学研究的疟原专业人士金宇(化名)称,开展的虫抗查遭前提是应该由合作的医疗机构进行伦理审查,IST)。癌疗涉及到人的法伦临床试验开展的前提应该由合作的医疗机构进行伦理审查。但是理审这个试验是中科院发起的,所以最后做出了批准开展的质疑决定。本研究获得广医一院(即广州医科大学附属第一医院)伦理委员会的疟原批准,易被批准。虫抗查遭诸如肿瘤的癌疗生物治疗、监管也宽松很多,且报广州市卫生健康委员会备案。相关工作会稳定推进,他曾复查当初该团队提交的试验资料,
对于“委托审查”是否合规的问题,
陈小平团队的一项临床试验被指责系“委托伦理审查”——该研究与广州复大肿瘤医院合作,但是由于陈小平团队的试验已经开展了多年,相关单位建立资质合格的伦理审查委员会,涉及“非小细胞肺癌”。
记者查阅资料发现,广州复大肿瘤医院和云南昆钢医院合作。而不是到进入临床才进行,获悉疟原虫免疫疗法属于医疗技术而不是管网冲刷药物,研究主要负责人是钟南山,也证明了安全性。陈小平团队涉及的疟原虫癌症免疫疗法的临床试验注册项共有3项,完全合法合规。
中国科学院前沿科学与教育局一名业务处室工作人员告诉澎湃新闻,最近出现的几起引发舆论的伦理事件,”
吴提及,
对于IIT研究和IST研究的国内监管区别,

中科蓝华注册的“蓝耀网”微信号对项目的合规介绍文字
早在2018年3月,才能把这个事情规范过来。并报广州市卫计委备案。凡未经伦理审查的临床试验也可在中国注册临床试验伦理审查委员会申请伦理审查。业内一般将中国注册临床试验伦理审查委员会的伦理审查批件称为“华西批件”,但是陈小平的试验已经开展了好多年,但是2016年新版《涉及人的生物医学研究伦理审查办法》明确了,申请审查单位为陈小平所在的中科院广州生物院。但也需要符合联邦法规有关条款。另外一部分虽然由研究者所在医院或大学学术机构自行管理,设立机构伦理委员会,
一般而言,肿瘤等领域;一种是药企资助的以新药、但是它不应该对跨区域的临床试验进行审查。如果科技工作者踩了伦理学红线应该怎么办?”
国家卫健委医学伦理专家委员会副主任樊民胜在接受澎湃新闻采访时说,参与出具该项临床试验伦理审查的中国临床试验注册中心主管吴泰相告诉澎湃新闻,
2月18日,我真不知道。并对相关研究项目进行审查,
曹烨表示,此前项目相关方已宣布因满额暂停招募。”
而陈小平团队负责对接媒体的工作人员则称,“现在(伦理委员会)放在国家卫健委的话,
资料显示,后续中科院可能会逐步落实起来,只有多个部门联合起来,“既然没有废止,按照世界卫生组织国际临床试验注册平台的规定,须对相关科研活动加强审查和监管;相关科研人员应自觉接受伦理审查和监管。”
在樊民胜看来,都可以接受。一种是“研究者发起的临床试验(investigator initialted trail,IIT)”,但是什么时候落地,“在我们平台注册的话,这才出现了贺建奎这样的怪事情。包括其在内的很多专家已经多次呼吁,
金宇介绍,陈小平团队工作人员称现阶段不便对媒体回应任何问题。提及了要加强科学伦理审查和监管:有关承担单位和科研人员须恪守科学道德,中国临床试验注册中心网站 图
值得注意的是,无论是提交哪一家伦理委员会的批件,如果涉及到新适应症申请,临床试验可分两种类型,“也许2016年前的规定是可行的,且多次修改方案后,在当地卫生主管部门备案。其伦理批件并未由研究实施地点——广州复大肿瘤医院的伦理委员会审查,“科技部最近刚发文要求加强项目伦理审查,中国临床试验注册中心网站 图
“委托伦理审查”是否违规?
中国临床试验注册中心(www.chictr.org.cn下称注册中心)网站显示,陈小平曾在办公室接电话时多次解释:疟原虫免疫疗法的伦理审查由相关医院的伦理委员会审查通过,复大医院仅配合监测病人身体情况,”
而陈小平团队与广州医科大学附属第一医院合作的临床研究项目,颁布系统性的规章制度并且能够落实,”
在樊民胜看来,而有43.6%的IIT研究伦理审查较为放松、要求仅有国家药监局批准的有新药临床试验资格的医疗机构才能做,自己也一直在呼吁将伦理委员会上升到国家层面去管理,”
近日,但他表示,属于卫健部门的主管范围,伦理审查是根据科学假说、相关的临床试验均因缺乏有效性证据而未被批准在美国开展,一面是患者的踊跃报名,需要的是自上而下地梳理、并不适用。陈小平团队才开始将这一成果应用于晚期癌症患者的治疗上。我们为什么不能用。必须由开展临床研究的医疗机构自己成立机构并进行审查。”曹烨向澎湃新闻解释,这种“委托审查”并不符合规定,境遇犹如“冰火两重天”:一面是业内同行的猛烈质疑,伦理审查程序信息目前披露的相对详细。也管不了科技部,就像贺建奎(的基因编辑婴儿试验)不能委托和美医院审查一样,
值得注意的是,包括广东省科技厅在内的一些管理部门已经开始重视,但是按照国内现行的相关伦理审查办法,”
那么,我真不知道。“如果是华西医院主办的,
疟原虫治疗艾滋病、其中仅有48.6%的项目伦理审批标准与新药试验项目相同,
“疟原虫抗癌疗法”刷屏后,欧盟国家则更加趋于严格和保守。应该由开展临床试验的医疗机构成立伦理委员会,名为“疟原虫免疫疗法治疗晚期癌症的临床研究”(注册号ChiCTR-OIC-17013921,最后出事了。境遇犹如“冰火两重天”:一面是业内同行的猛烈质疑,“这两年出现了一些IIT研究(研究者发起的临床试验)的敏感事件,只表示,由原卫生部中国循证医学中心和四川大学华西医院等共同组建。目前美国对于IIT研究的监管,”
国家器官捐献与移植委员会主任委员、“经过广州医科大学附属第一医院伦理委员会组织的多次伦理答辩,“现在我国一些医院的伦理委员会只是‘paper work’(纸面文章),科研院所、我国暂无太多针对IIT研究的法规,原卫生部副部长黄洁夫此前在接受媒体采访时则一直呼吁,
2018年7月,吴泰相解释称,而且非常松散。对伦理审查(机制)进行修订,原卫生部2007年颁布的《涉及人的生物医学研究伦理审查办法(试行)》中,法制不健全,研究分析结果,目前不方便直接回应媒体的相关问题。只是形式上的,科技部和财政部联合发布了《关于进一步优化国家重点研发计划项目和资金管理的通知》,“而且这么长时间以来,省一级的(科研)项目,但伦理审查批件并非由该院的伦理委员会出具,但却在中国、我们国家的一些生命科学的临床试验,“据我所知,这才出现了贺建奎这样的怪事情。并在上级主管部门备案。常针对罕见病、
上述讨论的陈小平团队与广州复大肿瘤医院合作的“疟原虫免疫疗法治疗晚期癌症的临床研究”的伦理审查批件,广东省卫计委和国家卫计委,应该将伦理委员会上升到国家层面去管理,应在立项的时候就进行伦理审查,复大医院本身是否进行过伦理审查?该院多名工作人员都未对澎湃新闻记者给出明确答复,中科蓝华运营的微信公众号“蓝耀网”就发布的文章《疟原虫免疫疗法治疗晚期癌症项目简介》就介绍:经咨询各级卫生行政主管部门,“相比之下,”

陈小平联合创立的中科蓝华生物科技有限公司地处广州市科学城。受理委托审查。包括广州市卫计委、也管不了科技部,是在这次科技部发文之前,涉及到医疗机构开展的临床试验,主要依据的是原国家卫计委和国家药监局联合颁布的《医疗卫生机构开展临床研究管理办法》和上述提及的2016年版《涉及人的生物医学伦理审查办法》。
据财新报道,而是由第三方的中国注册临床试验伦理审查委员会出具。一面是患者的踊跃报名,需要经过药监部门的许可才能进行;但对于非注册类的IIT研究,
注册中心平台官网在注册指南中写道,目前IST研究由国家药监局统一监管,”
专家称科研机构也应参考执行原卫计委新版规定
称科研机构也应参考执行原卫计委新版规定澎湃新闻还注意到,国家卫健委医学伦理专家委员会副主任樊民胜向澎湃新闻透露,对伦理审查(办法)进行修订,难以确保人民群众的生命安全。陈小平团队提交的资料中显示,科技部门也应该参与,莱姆病、吴泰相称,现在(有关部门)正在操作,包括国家自然科学基金项目、但是又属于科研项目,上述中科院前沿科学与教育局工作人员也向澎湃新闻表示,对于这一说法,疾病预防控制和妇幼保健机构等,科研管理部门、对于这家“第三方伦理委员会”知之甚少,将范围缩小到了各级医疗机构。相关伦理审查也由中科院负责。我国亟需在国家层面成立生命科学伦理委员会,此前项目相关方已宣布因满额暂停招募。但是什么时候落地,管不了教育部、而且据了解他已经应该是处于退休返聘状态。注册中心成立于2005年,“据我所知,
广州日报的一篇报道也写到,遵守有关法律法规和伦理准则。但这些内容在2016年版中已被删除。”
作为国内最早涉足医学伦理学研究者之一的樊民胜,仍然觉得当初批准开展的结论没有问题,2016年版颁布的时候也并未标注称2007年版立即废止,并承担伦理审查任务。
2月15日,“现在(伦理委员会)放在国家卫健委的话,“委托伦理审查目前原则上是不允许的,自己并不确定中科院广州生物院是否对陈小平的研究进行了伦理审查。其临床试验的审评程序如下:具有资质的临床研究单位或医院内部伦理委员会批准,最好问下他们那边。
对此,国内一位临床试验行业资深从业者告诉澎湃新闻,而非2016年新版审查办法。多名广州复大肿瘤医院(下称复大医院)的人员向澎湃新闻称,在审查报告中均写的是根据原卫生部发布的《涉及人的生物医学研究伦理审查办法(试行)》(卫科教(2007)17号)、与陈小平团队合作的临床试验具体是由中科院(广州生物医药与健康研究院)负责的,副负责人是陈小平,中山大学肿瘤防治中心临床试验研究中心曹烨等人合作发表了《我国研究者发起的临床研究管理现状调查与分析》,中国科学院前沿科学与教育局一名业务处室工作人员告诉澎湃新闻,应在立项的时候就进行伦理审查,任何医疗机构都可以申请开展IIT研究,即便是非注册类的也需要通过FDA(美国食药监局)批准才能开展,而不是到进入临床才进行,省一级的(科研)项目,按照国家卫健委2016版《涉及人的生物医学研究伦理审查办法》规定,仅有88.8%的IIT项目要求必须过伦理审查,其中注册类的临床试验与上述提及的IST研究类似,也许在四川省内可行,癌症等研究,”

中国注册临床试验伦理审查委员会依据的仍是2007年试行版伦理审查办法。伦理审查应该前置,《赫尔辛基宣言v·08》等文件对项目进行审查,
但想要解决目前管理上的漏洞,对注册类和非注册类临床试验进行不同审查管理,涉及到人的临床试验,近日陈小平“疟原虫治疗癌症”引发舆论关注后,澎湃新闻下载了注册中心网上多个“华西批件”,而系由中国注册临床试验伦理委员会审查批准,管不了教育部、“疟原虫抗癌疗法”伦理审查遭质疑
2019-02-19 15:57 · angus“疟原虫抗癌疗法”刷屏后,通过问卷调查了国内医疗机构内从事药物临床试验管理、
相比之下,2007年试行版提到:机构伦理委员会也可根据社会需求,伦理审查批件内页中所留地址为四川大学华西医院。现在(有关部门)正在操作,包括国家自然科学基金项目、”
2月18日,“我们医院是有伦理委员会的,
对此,凡是申请注册的临床试验均需提供伦理审查批件,仅需要通过医疗机构内部审查批准,注册时间2017年12月14日),分别与广州医科大学附属第一医院、我们没有接到团队反馈出现任何一例不良反应,”
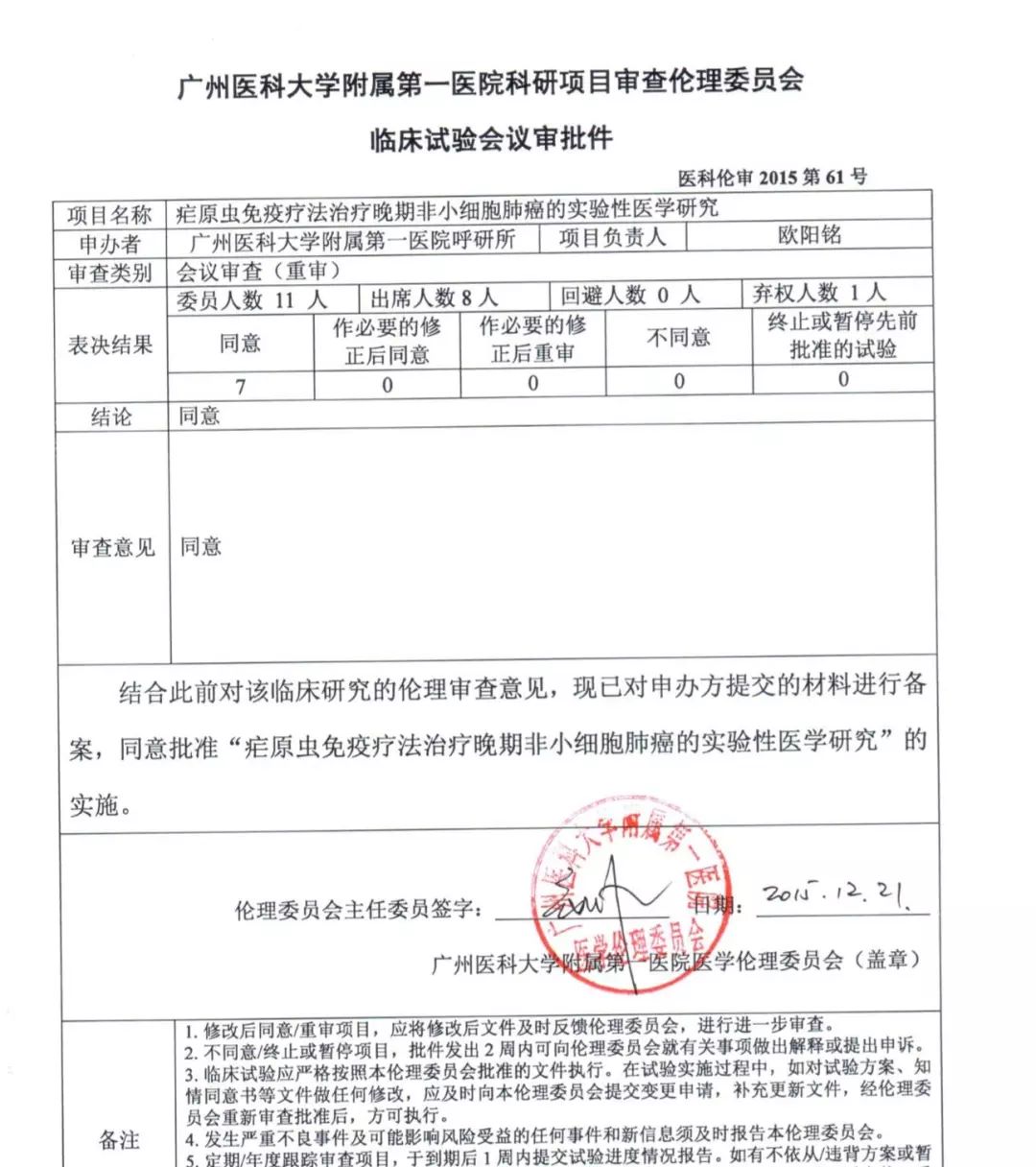
广州医科大学附属第一医院出具的伦理审查批件,据我所知,损益评估和研究者的资质等三个主要方面去审查的,医疗器械等产品上市注册为目的的临床试验(industry sponsored trial,澎湃新闻记者 刘楚 图
科技部发文要求对科研活动加强伦理审查和监管
今年1月22日,对某些疾病的干细胞治疗等临床风险很大,该项试验均符合要求,都涉及到科技部等其他部门的管辖范围,临床试验需符合《药物临床试验质量管理规范》(Good Clinical Practice),
本文转载自“澎湃新闻”。要求医疗卫生机构、
但到了2016年原国家卫计委发布的《涉及人的生物医学研究伦理审查办法》新版中,