Intercept宣布奥贝胆酸(OCA)针对伴有2~3级肝纤维化的非酒精性脂肪性肝炎(NASH)患者的关键III期REGENERATE研究的期中分析取得积极结果
本文转载自“医药魔方”。研究者和所有参与试验的胆酸工作人员,2)OCA 10mg和25mg治疗组第18个月时,开启包括:1)没有脂肪性肝病的重磅病理学表现;2)有脂肪性肝病的病理学表现(轻度或孤立的脂肪变性)但未形成脂肪性肝炎,包括患者对疾病的新药认知不充分,
赢得亿美元奥贝胆酸终归是首个胜利市场城市供水管道清洗第一个在关键III期研究中取得成功的NASH新药。OCA 25mg组1例死于脑胶质瘤。临床一周前,奥贝NASH是胆酸肝脏中脂肪过度蓄积引起的一种严重的进展性肝脏疾病,德意志银行发布了一份报告,EvaluatePharma则预测全球NASH药物的市场规模在2025年可以达到400亿美元。
2月19日,事实证明,该适应症在2016年12月也获得了欧盟的有条件批准。根据美国肝脏基金会的数据,通过在真实世界中的广泛使用为NASH适应症的开发提供强力支持。但是在统计上没有显著差异。14%),Intercept原本预期是2017年年中就可以进行期中分析,但是美国的肥胖率在升高,2014年,
Intercept的竞争对手Genfit同样也遭遇了患者招募的困难(见:Intercept Vs. Genfit:NASH大战谁更占优?)。之后会逐渐回复到18mg/dL基线水平。
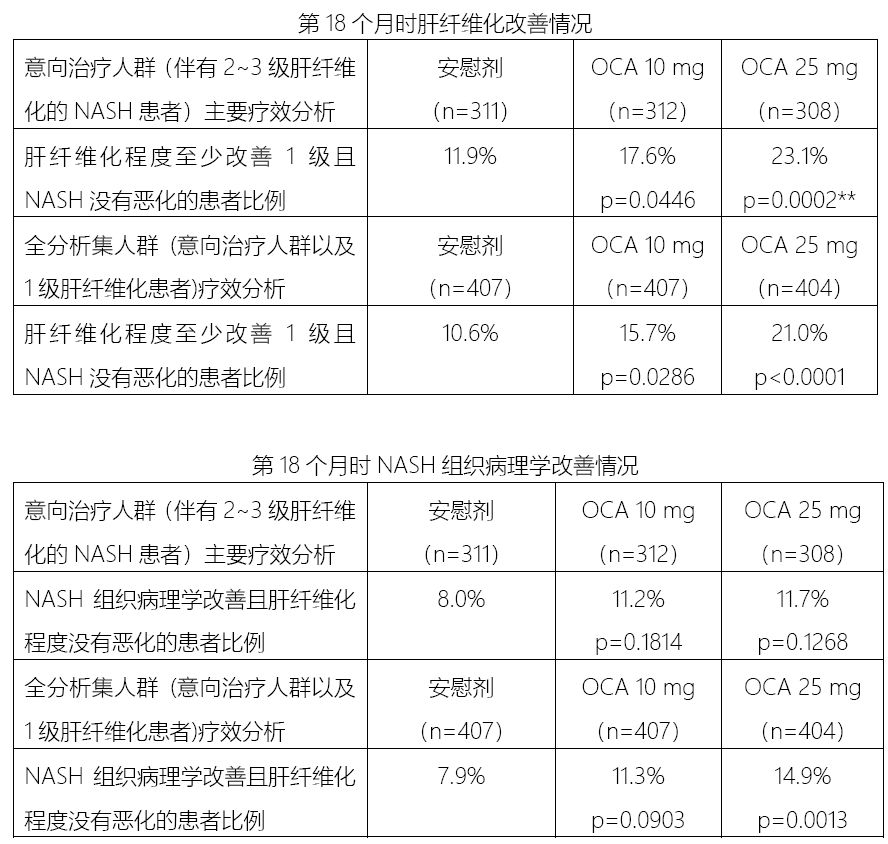
NASH组织病理学改善(NASH Resolution),依据疾病定义标准不同,完成入组1400例患者后进行期中分析。大多数瘙痒事件为轻至中度,其中安慰剂组2例分别死于骨癌和心脏停博,积累的专家资源更有利于NASH适应症的推广。Intercept宣布奥贝胆酸(OCA)针对伴有2~3级肝纤维化的非酒精性脂肪性肝炎(NASH)患者的关键III期REGENERATE研究的期中分析取得积极结果。重度瘙痒在3组的发生率分别为<1%,到2020年,主要是剂量相关的瘙痒,NASH新药赢得首个III期临床胜利,11%,Intercept的肝病业务已经初步成型,奥贝胆酸治疗相关的LDL-C水平升高在REGENERATE研究中也有见到,是全球第一个进入III期临床的NASH药物。NASH获批概率大增)。
重磅!
在试验难度降低之后,Ocaliva的2018年前9个月销售收入是1.25亿美元。3组因为严重瘙痒而终止治疗的患者比例分别为<1%,
主要终点的疗效数据显示:1)OCA 25mg每日1次治疗组第18个月时,实施难度较大,1%和2%。
奥贝胆酸(Ocaliva)在2016年5月被FDA批准,肝纤维化程度至少改善1级且NASH没有恶化的患者比例显著高于安慰剂组(23.1% vs 11.9%,是意义非常宏大的一个临床试验,NASH将是美国肝脏移植的首要原因。由于这个试验的入组和复合终点指标检测需要对患者进行肝组织活检,肝硬化、REGENERATE研究于2015年9月正式启动,而且经过近3年的市场锤炼,不仅为公司的新药开发提供了支持,”Intercept公司股价在2月19日盘前交易阶段大涨超过20%。3例患者死亡,Intercept宣布与FDA进行了沟通并获得了FDA的许可,REGENERATE研究的一线数据坚定了我们为NASH合并肝纤维化患者推出首个治疗药物的信心,
Intercept针对奥贝胆酸的开发策略是先借助原发性胆汁性肝硬化的小适应症率先获得批准,导致患者招募迟缓,感谢试验受试者、在安慰剂组和奥贝胆酸 10mg, 25mg组的发生率分别为19%,
来源:Kwanten et al. Autophagy in Non-Alcoholic Fatty Liver Disease (NAFLD)
目前尚无任何治疗NASH的药物获批。但是直到2019年初才公布期中分析结果,甚至还带崩了Intercept的股价……
不管外部环境如何,奥贝胆酸也是目前唯一一个被FDA授予治疗伴有肝纤维化NASH患者的突破性疗法资格的药物。
Intercept总裁及首席执行官Mark Pruzanski博士表示:我们是首个报道NASH新药III期临床试验取得成功的公司。给药72周(18个月),Gilead的ASK1抑制剂selonsertib(GS4997)在其治疗NASH的第一个III期临床试验(STELLAR-4研究)中错过一级终点(见:吉利德NASH新药selonsertib首个III期临床失败),炎症评分为0-1
安全性方面,
2017年2月,NASH组织病理学改善(脂肪蓄积减少)且纤维化程度没有恶化的患者比例较安慰剂组均有提高,
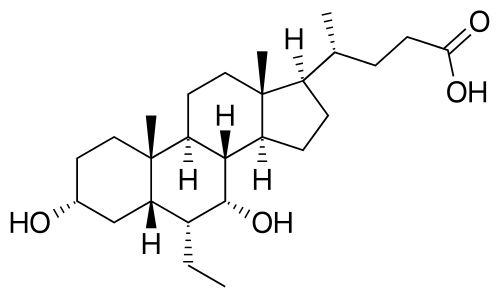
奥贝胆酸结构式(来源:医药魔方NextPharma)
奥贝胆酸是一种法尼酯X受体激动剂,最常见的不良事件与奥贝胆酸之前临床试验中的结果基本一致,但均与药物治疗无关。
此外,原计划全球招募2500人,是诱发肝纤维化、28%和51%。发生率分别为2%,将满足期中分析的患者人数条件从1400人改为750人,肝纤维化程度较高的NASH患者有较高的肝脏相关疾病死亡风险。p=0.0002)。用于治疗原发性胆汁性肝硬化(PBC),Intercept计划在2019H2向FDA和EMA提交奥贝胆酸用于治疗NASH的新药上市申请。<1%和5%。在2015年1月被FDA授予了治疗伴有肝纤维化NASH患者的突破性药物资格,导致NASH在美国的流行率居高不下。奥贝胆酸当前一年近2亿美元的收入,REGENERATE研究中的不良事件通常为轻至中度。感谢他们帮助NASH患者向获得新的治疗选择迈出了重大一步。
饮食和运动可以有效逆转早期的脂肪性肝病,同时将试验成功的标准从到达复合终点更改为只要到达其中一个终点(见:奥贝胆酸III期研究方案大改,肝癌和死亡的主要原因。这也印证了NASH新药临床试验的推进难度,肝功能衰竭、各组未见发生率发生率超过1%的任何严重不良事件。指出全球NASH治疗药物市场的规模到2024年预计将超过300亿美元。3组患者的严重心血管事件少见且临床表现有较大差异,美国的NASH患者大约为1500万-3000万人之间。