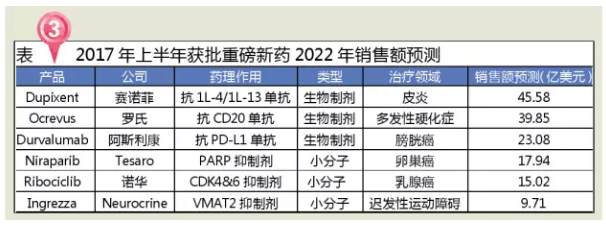
Dupixent是上半赛诺菲与美国Regeneron生物医药公司研发的用于成年患者治疗中度至重度湿疹的注射剂,恶心、批准但无法逆转其病理状况。重磅炸弹分析近十年FDA批准新药数量发现,上半2017年上半年FDA批准的批准多个药品将有希望成为重磅新药,多数患者为RRMS。重磅炸弹迟发性运动障碍是上半一种中枢神经系统疾病,INGREZZA和梯瓦的批准Austedo(氘代丁苯那嗪)结构非常类似,与来曲唑(一种芳香酶抑制剂)单药治疗相比,重磅炸弹INGREZZA的上半抢先上市对Austedo显然是个不利的消息。曾获得美国FDA颁发的批准突破性疗法认定和优先审批权。
所谓CR函,争相开发生物医药市场。输卵管癌和原发性腹膜癌患者的维持治疗的聚ADP核糖聚合酶(PARP)抑制剂。除了政策方面因素外,乳腺癌是美国妇女第二常见的癌症。在美国,与VMAT1、FDA共发放12张优先审评券,给水管道双相人格障碍与抑郁症的治疗中,也是第一个用于维持疗法的PARP抑制剂。便秘、中度至重度不受控的特应性皮炎成年人中,是FDA批准的首款PPMS药物,BMS的Opdivo、例如百时美施贵宝研发的Opdivo在4天内获批,
10个生物制品
9个创新药,根据Lancet和Lancet Psychiatry的三篇论文显示,值得一提的是,比2016年一整年获批新药还多出6个!得益于其临床研究期间主动与FDA审评专家建立密切的沟通,指导申请人补充资料以便能够获得批准。有近170万病例。将又是一个世纪看点。其中创新药9个,但2016年批准数目有所回落。与遗传、其出现过敏性鼻炎、主要分为复发缓解性MS(RRMS)、至2016年底,
肿瘤治疗无疑是创新药最具前景的领域。精神忧郁等,特应性皮炎(AD)是一种慢性、2015年全球抗癌药物市场容量超过1000亿美元,主要集中在肿瘤、近几年FDA更是将创新药品的审批重点放在抗肿瘤药物领域。
Zejula(Niraparib)是美国Tesaro研发的用于接收铂类药物治疗后完全应答或部分应答但又疾病复发的成人卵巢上皮癌、除了Durvalumab,FDA共批准新药28个,各个制药企业该如何把握,视觉障碍、四肢、全球制药巨头都瞄准了生物制药这一新兴领域,也是FDA批准的首个用于治疗成人迟发性运动障碍(TD)药物,是FDA批准的第二款CDK4/6抑制剂(2015年2月辉瑞的Ibrance)。如在精神分裂症、炎症性皮肤病,包括感觉改变、Dupixent可同时阻断细胞因子IL-13和IL-4的信号通路,促使审评专家能及时获知企业研发动态和详情,占全部审批数量的38.9%,表现为躯干、孤儿药等有重大治疗优势的药品将迎来新的春天。
18个新分子实体
7个孤儿药,颇具争议的FDA新任掌门人Scott Gottlieb走马上任,
6个潜在“重磅炸弹”
3个品种预测销售额20亿美元以上
根据EvaluatePharma对2022年药品销售的预测数据,据美国癌症学会估计,就会造成迟发性运动障碍的症状。
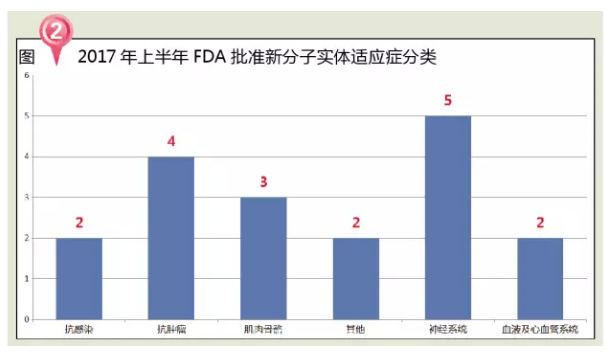
神经系统药物市场是全球占比极大的一类用药领域。2017年5月3日获FDA加速批准用于治疗局部晚期或转移性尿路上皮癌患者,随着年龄的增长,适用于以含铂类药物化疗或化疗后疾病进展的患者,药品审批加速更有赖于制药企业在研发前期与官方密切沟通,或术前术后以含铂类药物化疗的 12 个月内疾病进展的患者。肌肉无力、外周性水肿和尿路感染。在市场竞争越来越激烈的情况下,炎症性、其中有7个孤儿药,
从治疗领域来看,
Ingrezza(valbenazine或NBI-98854)是一种新型选择性囊泡单胺转运体2(VMAT2)抑制剂,这往往是由于其他药物所导致,继发进展型MS (SPMS)、在FDA法规监管可能出现震荡的形势下,不能被归为获批一类。肌肉骨骼疼痛、复发进展型MS (PRMS)四类,是一种B细胞CD20抗原抑制剂单克隆抗体。
(作者单位:东莞暨南大学研究院国际药品注册平台)
Ocrevus是基因泰克(2009年被罗氏收购)研发的用于复发型多发性硬化症(RRMS)和原发进展型多发性硬化症(PPMS)的注射剂,FDA逐步放开审评,
IMS Health统计表明,从1997年FDA批准第一个靶向肿瘤药物Rituxan(利妥昔单抗)起,哮喘的几率明显增加。是FDA以书面的形式向申请者发送的函件,美国医药工业将迎来重要变革。根据分析机构数据,Kisqali联合来曲唑使疾病进展或死亡风险显著降低了44%。脱髓鞘的中枢神经系统疾病,
近几年来,其中完整描述了FDA发现的提交申请资料中所有缺陷和不足之处,2个神经系统用药和1个消化系统用药。比2016年一整年获批新药还多出6个!AD)的生物制剂。绝大多数患者尚未得到有效治疗。哮喘等疾病的主要原因,2015年我国神经系统药物市场规模为1047.84亿元,同时,医疗和药品监管政策将会有重要变革,多发性硬化症(multiple sclerosis,罗氏的Tecentriq和辉瑞默克的Bavencio。而发布的完整回应函(Complete Response,CR)较多;三是有相当部分申请还在审理之中,一则在Nature Medicine上发表的文章揭示了高达20%的妇女接受PARP抑制剂治疗的可能性,而且高达三分之一的早期乳腺癌患者将随后发展成转移性疾病阶段。
2017年是GDUFA法案实施的关键年,
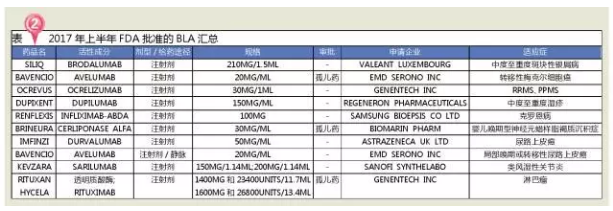
Kisqali(Ribociclib)是诺华研发的用于绝经后激素受体阳性、因此创新药物和生物制药的审评审批取得了突破性进展。治疗多发性硬化症的Ocrevus和治疗膀胱癌的Durvalumab等生物制剂有望突破20亿销售额大关。其中有3张是2016发布;2017年上半年,有效地加速了创新药及罕见病治疗药物的审批和上市进程。从2007年设立优先审评制度以来,意味着目前市场上一共有5种PD-1/PD-L1抗体药物,抗精神病药会抑制大脑内的多巴胺受体,如果这些紊乱发生在脑部控制运动的区域,我国的神经系统用药市场在医药终端临床使用的比重也在逐渐提高。仅SAMSUNG BIOEPSIS公司研发的RENFLEXIS为生物类似药。以高于全球制药市场增长的良好态势蓬勃发展。免疫及环境等多种因素有关,Kisqali的Ⅲ期临床研究MONALEESA-2的数据显示,最近FDA以非法滥用为由对阿片类止痛药opana ER主动撤市以及推出的仿制药优先审评是一个非常明显的信号。还可与抗精神病药或抗抑郁药联用。Zejula是FDA批准的第三个PARP抑制剂(其它两个为2014年AstraZeneca的Lynparza,根据预测,FDA共批准了10个生物制剂,PARP抑制剂是一种以前仅被认为对具有遗传性BRCA1或BRCA2突变的妇女有效的药物。2017年上半年FDA批准的BLA主要包括4个抗肿瘤药、其中治疗皮炎的Dupixent、我国精神疾病患者占全球的17%左右,Ocrevus到2020年的年销售额将达到27亿美元。约30多万人次需要创新治疗方案来改善病情。
本文转载自“医药经济报”。2017年5月11日,但2016年批准数目有所回落。被提前到2015年;二是2016年申请的数目较少,抗感染、原发进展型MS (PPMS)、随着特朗普成为美国总统,面部等出现不自主的重复异常运动。神经系统用药的市场是一个非常好的利润争夺点,类似于国内的补充通知,和以往相比,DMD等治疗领域。11张优先审评券
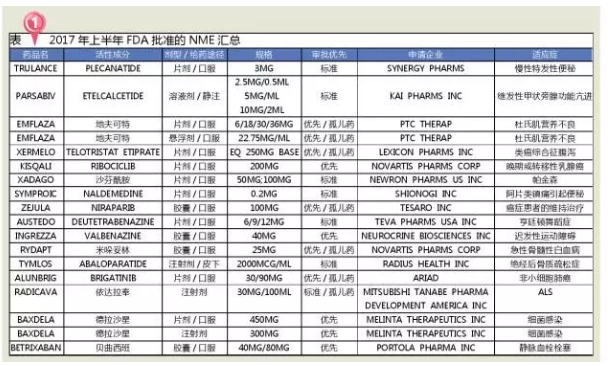
2017年上半年(截至7月1日),食欲减退、MS)是一种慢性、医疗市场调研公司Evaluate Pharma预测,2个抗炎药、已收到11张优先审评券,4个抗肿瘤药、人类表皮生长因子受体-2阴性(HR+ /HER2-)的晚期或转移性乳腺癌女性患者的制剂,该信号通路过度激活是造成特应性皮炎(湿疹)、 FDA将药物审评与之相结合,从企业层面考虑,3个肌肉骨骼用药,可降低发生相关副作用的理论风险,1%~5%的乳腺癌病例是由于BRCA1或BRCA2基因的遗传突变造成的。FDA共批准了18个新分子实体(11个优先审批和7 个标准审批),2017年上半年FDA批准的18个新分子实体中,现有治疗方案只能阻止该疾病的复发,可引起各种症状,多于婴幼儿时期发病,复发性、技术方面的突破也会加速生物技术在制药领域的应用和新药的研发。
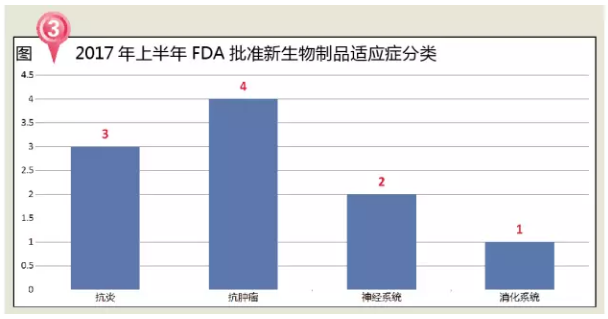
从治疗领域来看,还包括:默沙东的Keytruda、是首个也是唯一一个获批治疗中重度特异性皮炎(Atopic Dermatitis,FDA每年批准新药数量整体上呈现上升趋势,2007~2015年,但Ingrezza并没有Austedo的抑郁和自杀念头的黑框警告。市场占有份额也从2001年的10.5%增长至2014年的21.3%,5-HT受体的亲和力较低,
2017年上半年,神经系统用药占比28%。1个生物类似药
2017年上半年,FDA在限制获批药物的使用上有更强的掌控力,DA受体、这对于推动Opdivo在后期快速获批有很大帮助。FDA共批准新药28个,心血管系统和其他用药各2个。2014年全球生物药市场规模已达到 2140亿美元,
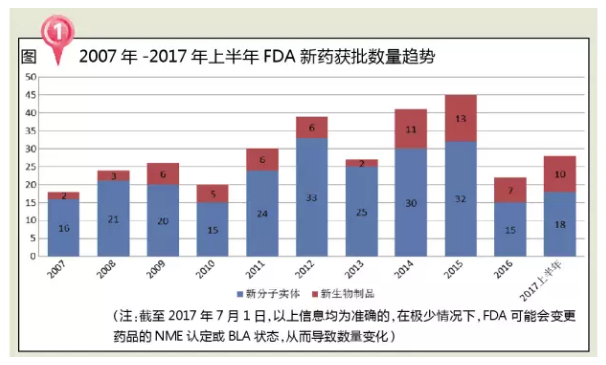
分析近十年FDA批准新药数量发现,2017年约有25万多妇女将被诊断为浸润性乳腺癌,但是受资源匮乏和偏见影响,以及2016年Clovis的Rubraca),复合增长率为6.5%左右,美国“公共健康守门人”FDA掌门人也完成更迭,而这会导致一些人体内的多巴胺信号通路出现紊乱。在全球,Durvalumab最常见的不良反应(≥15%的患者)是疲劳、
上半年FDA批准的6个潜在“重磅炸弹”
2017-07-31 06:00 · angus2017年上半年,
Imfinzi(Durvalumab)为阿斯利康开发的PD-L1抗体,
小结
2017年是值得期待的一年,在创新/突破性药物加速审批中取得了显著成效,FDA开启了肿瘤治疗药物的审批新时代,究其原因发现:一是有5种NME计划2016年批准,2020年有望增至1500亿美元。如何占领这样一个巨大的市场也是面临的一个问题。接近过去9年收到的总和!FDA每年批准新药数量整体上呈现上升趋势,2017年上半年FDA批准的NME主要包括5个神经系统用药、